Acide benzoïque
L'acide benzoïque, de formule chimique C 6 H 5 COOH est un acide carboxylique aromatique dérivé du benzène.
Recherche sur Google Images :
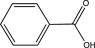
Source image : scienceamusante.net Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- valeur du pKa du couple acide benzoïque / ion benzoate : pKa = 4, 2. zone de virage du rouge de crésol [7, 2 ; 8, 8] ; jaune en milieu acide; rouge en milieu... (source : chimix)
- benzoate C6H5-COO- (base conjuguée de l'acide benzoïque) en solution aqueuse.... PURIFICATION DU BENZOATE DE SODIUM ET FORMATION DE L'ACIDE BENZOÏQUE... (source : labotp)
- Ceci Réactif de Grignard est lentement ajouté à glace sèche pour donner le benzoate. L'acide dilué est ajouté à l'acide benzoïque de forme.... (source : worldlingo)
| Acide benzoïque | ||
|---|---|---|
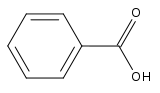 |
||
| Général | ||
| Nom IUPAC | acide benzoïque | |
| Synonymes | Acide benzènecarboxylique | |
| No CAS | ||
| No EINECS | ||
| No E | E210 | |
| FEMA | ||
| Apparence | cristaux blancs ou poudre[1]. | |
| Propriétés chimiques | ||
| Formule brute | C7H6O2 [Isomères] |
|
| Masse molaire[2] | 122, 1213 ± 0, 0066 g·mol-1 C 68, 85 %, H 4, 95 %, O 26, 2 %, |
|
| pKa | 4, 2 | |
| Propriétés physiques | ||
| T° fusion | 122, 35 °C[1] | |
| T° ébullition | 249 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 2, 9 g·l-1[1], Bonne dans le chloroforme, l'éthanol et l'acétone |
|
| Masse volumique | 1, 3 g·cm-3[1]
|
|
| T° d'auto-inflammation | 570 °C[1] | |
| Point d'éclair | 121 °C (coupelle fermée) [1] | |
| Pression de vapeur saturante | à 25 °C : 0, 1 Pa[1]
|
|
| Point critique | 45, 6 bar, 478, 85 °C [4] | |
| Thermochimie | ||
| S0solide | 165, 7 J/mol·K sous 1 bar | |
| ΔfH0solide | 384, 8 kJ/mol | |
| Cp | 148 J/mol. K à 300 K 259 J/mol·K à 413 K (liquide) |
|
| Cristallographie | ||
| Classe cristalline ou groupe d'espace | P21/c [6] | |
| Paramètres de maille | a = 5, 500 Å b = 5, 128 Å |
|
| Volume | 613, 96 Å3 [6] | |
| Densité théorique | 1, 321 [6] | |
| Propriétés optiques | ||
| Indice de réfraction | 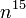 1, 5397 [7] 1, 5397 [7] |
|
| Précautions | ||
|
|
||
|
||
|
|
||
| Phrases R : 22, 36, | ||
| Phrases S : 24, | ||
|
|
||
|
|
||
 |
||
| Écotoxicologie | ||
| DL50 | 1 700 mg·kg-1 (rats, peroral) | |
| LogP | 1, 87[1] | |
|
|
||
L'acide benzoïque, de formule chimique C6H5COOH (ou C7H6O2) est un acide carboxylique aromatique dérivé du benzène.
Il est utilisé comme conservateur alimentaire et est naturellement présent dans certaines plantes. C'est par exemple l'un des principaux constituants de la gomme benjoin, utilisée dans des encens dans les églises de Russie et d'autres communautés orthodoxes. Quoiqu'étant un acide faible, l'acide benzoïque n'est que peu soluble dans l'eau du fait de la présence du cycle benzénique apolaire.
Parmi les principaux composés qui dérivent de l'acide benzoïque, on peut citer l'acide salicylique et l'acide acétylsalicylique plus connu sous le nom d'aspirine.
Comme additif alimentaire, il est référencé en Europe sous le code E210. Ses sels, qu'on nomme des benzoates, sont référencés sous les numéros :
- E211 Benzoate de sodium (Ba)
- E212 Benzoate de potassium (Ba)
- E213 Benzoate de calcium (Ba)
Il est reconnu comme un additif cancérigène[réf. nécessaire]. Au-dessus de 370 °C, il se décompose en formant du benzène et du dioxyde de carbone. L'acide benzoïque a une odeur forte et est aisément inflammable.
Historique
En 1830, Wöhler rencontre Justus von Liebig, qui poursuit des recherches identiques sur les cyanates. Ils extraient, en 1837, l'amygdaline à partir des amandes amères, et découvrent l'acide benzoïque en oxydant l'amygdaline par l'acide nitrique. En 1832, ils publient les résultats de travaux et montrent que les radicaux organiques peuvent se combiner à l'hydrogène électropositif autant qu'à l'oxygène électronégatif. Ils éditent ensemble les Annalen der Chemie und Pharmazie.
Production
Production industrielle
L'acide benzoïque est produit industriellement par oxydation partielle du toluène par l'oxygène en phase gazeuse en présence de catalyseurs tels que, par exemple, le pentoxyde de vanadium (V2O5).
Synthèse au laboratoire
L'acide benzoïque est peu cher et disponible auprès de nombreux fournisseurs. Sa synthèse au laboratoire est uniquement pratiquée à titre d'exercices pédagogiques.
- L'oxydation du toluène, de l'alcool benzylique ou du benzaldéhyde par le permanganate de potassium produit aussi de l'acide benzoïque.
- On peut l'obtenir par l'hydrolyse d'un composé de même niveau d'oxydation que lui (par exemple à partir du benzonitrile ou du benzamide).
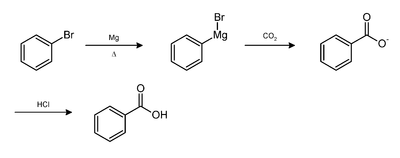
- On peut aussi l'obtenir par combinaison d'un organomagnésien. Le schéma réactionnel ci-dessous montre par exemple l'obtention de l'acide benzoïque à partir du bromobenzène.
Précautions
- Phrases de risque :
- R22 (Nocif en cas d'ingestion)
- R36 (Irritant pour les yeux)
- Conseils de prudence :
- S24 (Éviter le contact avec la peau)
Risques
Selon une étude britannique publiée en 2007, l'acide benzoïque facilite l'hyperactivité infantile, plus exactement le trouble du déficit de l'attention[9], [10].
Alimentation
L'acide benzoïque fait partie des additifs alimentaires, et porte le numéro SIN E210[11]
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l'Union européenne : cette substance active est inscrite à l'annexe I de la directive 91/414/CEE par la directive 2004/30/CE.
- pour la France : cette substance active est autorisée dans la composition de préparations bénéficiant d'une autorisation de mise sur le marché.
Voir aussi
- Benzoate de sodium
- Liste des acides
- PTBBA (Acide 4-tert-butylbenzoïque)
Liens externes
Références
- ACIDE BENZOIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers'Handbook, McGraw-Hill, USA, 1997, 7e éd. , 2400 p. (ISBN 0-07-049841-5) , p. 2-50
- Properties of Various Gases sur flexwareinc. com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Gulf Pub. Co., Huston, Texas (ISBN 0-88415-858-6)
- Benzoic acid sur www. reciprocalnet. org. Consulté le 12 décembre 2009
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd. , 1623 p. (ISBN 0071432205) , p. 2.289
- «Acide benzoïque» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Jim Stevenson et alli, université de Southampton, in The Lancet, septembre 2007. Etude relatée dans Le Monde, 7 septembre 2007.
- documentaire "Reporter" diffusé sur [www. rtlinfo/reporter. be RTL-TVI] le vendredi 05 février 2010
- Codex alimentarius, «Noms de catégorie et dispositif international de numérotation des additifs alimentaires» sur http ://www. codexalimentarius. net, 2009. Consulté le 19 mai 2010
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 04/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité