Trichloréthylène
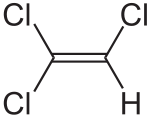
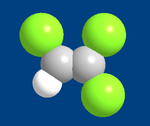
Le trichloréthylène est un composé organique de formule brute C 2 H Cl 3 et de formule semi-développée ClCH=CCl 2.

Catégories :
Produit chimique toxique - Cancérogène chimique - Produit chimique dangereux pour l'environnement - Chloroalcène - Solvant
Recherche sur Google Images :

Source image : leblogjuridique.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ... Il est quasiment insoluble dans l'eau, mais miscible à la... 70 % du trichloréthylène est éliminé sous forme inchangée dans l'air expiré... (source : uvmt)
- Trichloréthylène : Le Trichloréthylène est un solvant utilisé en particulier pour le nettoyage des tissus et des vêtements.... (source : verte-nature)
| Trichloréthylène | |||
|---|---|---|---|
  |
|||
| Général | |||
| Synonymes | 1, 1, 2-Trichloroéthylène Trichloroéthène |
||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES |
|
||
| InChI |
|
||
| Apparence | liquide incolore, d'odeur caractéristique. [1] | ||
| Propriétés chimiques | |||
| Formule brute | C2HCl3 [Isomères] |
||
| Masse molaire[3] | 131, 388 ± 0, 008 g·mol-1 C 18, 28 %, H 0, 77 %, Cl 80, 95 %, |
||
| Moment dipolaire | 0, 80 D [2] | ||
| Diamètre moléculaire | 0, 529 nm [2] | ||
| Propriétés physiques | |||
| T° fusion | -73 °C[1] | ||
| T° ébullition | 87 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 1 g·l-1[1] | ||
| Masse volumique | 1, 5 g·cm-3[1], Vapeurs plus denses que l'air |
||
| T° d'auto-inflammation | 410 °C[1] | ||
| Limites d'explosivité dans l'air | 8–10, 5 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 7, 8 kPa[1] | ||
| Point critique | 50, 5 bar, 298, 85 °C [4] | ||
| Thermochimie | |||
| Cp |
|
||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9, 46 ± 0, 02 eV (gaz) [6] | ||
| Propriétés optiques | |||
| Indice de réfraction | 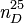 1, 475 [2] 1, 475 [2] |
||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 36/38, 45, 52/53, 67, | |||
| Phrases S : 45, 53, 61, [7] | |||
|
|
|||
|
|||
|
|
|||
|
|
|||
 |
|||
|
|
|||
 Danger |
|||
|
|
|||
| Groupe 2A : Certainement cancérogène pour l'homme[8] | |||
| Inhalation | amener à l'air frais, peut-être réanimation cardiopulmonaire | ||
| Peau | enlever les vêtements souillés, laver à grande eau, montrer à un médecin | ||
| Yeux | laver à grande eau en désormais les paupières ouvertes, montrer à un ophtalmologiste | ||
| Ingestion | ne pas faire boire, ne pas faire vomir, contacter un médecin. | ||
| Écotoxicologie | |||
| LogP | 2, 42[1] | ||
| Seuil de l'odorat | bas : 0, 5 ppm haut : 167 ppm[11] |
||
|
|
|||
Le trichloréthylène (ou trichloroéthylène) est un composé organique de formule brute C2HCl3 et de formule semi-développée ClCH=CCl2.
Il est aussi nommé trichloréthène (ou trichloroéthène), trichlorure d'éthylène ou d'éthène, trilène ou tout simplement trichlo ou trichlore.
Il s'agit d'une molécule d'éthène dont trois atomes d'hydrogène ont été remplacés par des atomes de chlore.
Dangers et précautions d'emploi
En 1995, le trichloréthylène a été classé «carcinogène[12] probable» (il était jusque là classé «carcinogène envisageable») par l'International Agency for Research on Cancer (IARC). Ceci a été entériné par la directive européenne 2001/59/CE de la Commission du 6 août 2001 portant vingt-huitième adaptation au progrès technique de la directive 67/548/CEE.
Il irrite la peau et les muqueuses, et est un toxique pour le système nerveux central : inhalé à de fortes teneurs (au-delà de 3 000 ppm), il peut entraîner le coma ou alors la mort en quelques minutes. De nombreux cas de maladie professionnelle ont été rapportés suite à une manipulation prolongée.
En présence de flamme ou a une température supérieure à 120 °C il peut se décomposer en :
- monoxyde de carbone CO,
- chlorure d'hydrogène HCl,
- dichlore Cl2
trois gaz extrêmement toxiques.
S'il est lui-même non combustible, par contre, ses vapeurs peuvent être explosives si elles se mélangent avec l'air (elles sont plus lourdes que l'air) L'eau mais aussi certains métaux (aluminium) provoquent la décomposition du trichloréthylène avec production d'acide chlorhydrique. L'acide chlorhydrique peut être neutralisé par ajout de stabilisants.
Il doit être stocké dans un lieu bien ventilé, avec une température comprise entre 15 °C et 25 °C. Il doit être manipulé en milieu bien ventilé, avec des gants et des lunettes de protection. L'INRS préconise l'utilisation de gants en PVA (alcool polyvinylique). En cas d'exposition accidentelle de la peau et des muqueuses, il faut enlever les vêtements souillés, laver abondamment à l'eau et consulter un médecin.
Selon la réglementation européenne, son utilisation est interdite pour les particuliers à une concentration supérieure à 0, 1 %. Dans l'industrie, il faut procéder si envisageable à son remplacement par d'autres produits comme le tétrachloroéthylène (ou perchloroéthylène), le chlorure de méthylène (ou dichlorométhane (DCM) ), d'autres dérivés d''hydrocarbures (cétones, alcools, …), ou par certains fluoroalcanes.
Le trichloroéthylène est nocif pour la santé s'il est ingéré. Il cause une sensation de brûlure dans la bouche et la gorge, suivie de douleurs abdominales et des signes et des symptômes de dépression du dispositif nerveux central. L'ingestion accidentelle de 30 mL à 500 mL (de 2 cuillères à table à 16 onces) cause un affaiblissement musculaire, des vomissements et la perte de conscience ou le délire, mais la victime récupère dans les deux semaines. Aucun effet n'a été signalé sur le cœur, le foie et les reins. Dans un cas uniquement, l'ingestion de moins de 50 mL s'est avérée fatale suite à une insuffisance rénale et hépatique. Certains des effets nocifs décrits par exemple les effets sur le foie, peuvent être dus à d'autres substances chimiques (stabilisants) ajoutées au trichloroéthylène[13]. La concentration maximale acceptable dans l'eau potable pour le TCE est de 0, 005 mg·l-1[14].
Utilisation
Les deux principales caractéristiques intéressantes du trichloréthylène sont :
- qu'il s'agit d'un solvant ;
- que au contraire de la majorité des solvants, il est peu inflammable.
Il a énormément été utilisé pour le dégraissage de pièces métalliques, le nettoyage à sec de vêtements et l'extraction de produits organiques. Il fut utilisé comme anesthésiant sous le nom trilène.
Il tend à être progressivement remplacé par des produits moins dangereux, et est d'ores et déjà interdit pour les particuliers dans l'Union européenne.
Le trichloroéthylène sert en particulier au dégraissage à la vapeur des pièces métalliques dans les industries de l'automobile et des métaux. Il sert aussi de composante d'adhésifs et de solvant dans les décapants à peinture, les lubrifiants, les peintures, les vernis, les pesticides, les nettoyeurs à froid pour métaux, les caoutchoucs et les élastomères. Il est utilisé comme caloporteur à basse température et comme intermédiaire chimique dans la production de produits pharmaceutiques, d'agents chimiques ignifuges et d'insecticides. Il est utilisé dans la phosphatation des métaux, la transformation des textiles, la production de chlorure de vinyle et les opérations aérospatiales[15].
Le trichloréthylène passe en catégorie 2 des substances cancérogènes (Directive de l'Union Européenne sur les substances dangereuses) avec la phrase de risque R45 "peut causer le cancer". C'est ce qu'ont décidé les Experts Européens lors de la réunion (28ème Adaptation au Progrès Technique) du 25 janvier 2001, confirmant ainsi la recommandation du groupe de travail de l'Union Européenne, chargé de la classification, de l'emballage et de l'étiquetage. Rappelons que le trichloréthylène était en catégorie 3 des cancérogènes, étiqueté R40 "Effet cancérogène suspecté-preuves insuffisantes".
Contamination au TCE
Les eaux souterraines forment l'unique source d'eau pour 25 à 30 % de la population canadienne, c'est-à-dire 7, 1 million de Canadiens[16]. La municipalité de Shannon, municipalité de la province de Québec (Canada) réalise des analyses et remarque que la nappe phréatique est contaminée par du trichloréthylène (TCE), ce qui cause une augmentation des cancers dans cette région. Les gens de la ville ont décidé d'intenter un recours collectif contre le gouvernement du Canada car ce dernier connaissait le problème depuis 30 ans[17].
Un cluster de cancer (leucémie et autres), impliquant des composés organiques volatiles dégagés par une entreprise de nettoyage à sec, dont du trichloréthylène, du 1, 2-dichloroéthylène, du perchloroéthylène, du dichlorométhane et du chlorure de vinyle, a été découvert à Camp Lejeune, en Caroline du Nord [18].
Dosage du trichloroéthylène
Le trichloroéthylène est un contaminant émergeant problématique pour l'environnement, la faune et l'humain. Il est issu de l'activité industrielle de l'homme et s'accumule dans la nature progressivement causant des dommages importants. L'accumulation du trichloroéthylène dans les eaux des nappes phréatiques est un des principaux problèmes touchant les eaux potables souterraines des petites municipalités[réf. nécessaire]. C'est pourquoi il est important de doser le trichloroéthylène dans les eaux souterraines. Pour doser le trichloroéthylène dans l'eau, on peu utiliser une technique d'analyse telle la chromatographie gazeuse couplée à un spectromètre de masse avec un ratio isotope (GC-MSIR) [19].
Avant l'analyse, les échantillons d'eau souterraine ont été conservés à dans des contenants de verre scellés avec du téflon. Pour doser le trichloroéthylène, on utilise en premier lieu une pompe à extraction offline qui a pour rôle de préconcentrer l'analyte volatil organique.
Initialement, l'échantillon de 500 ml contenu dans le contenant d'échantillon en acier inoxydable est transféré vers le contenant d'extraction en acier inoxydable en ouvrant la valve (V1) [20]. Par la suite, le contenant d'extraction est brassé mécaniquement à une vitesse de 120 tours par minute. La valve (V2) est ouverte et le composé volatil organique, le trichloroéthylène, passe par un tuyau d'acier inoxydable chauffé à pour éviter la condensation de vapeur d'eau durant l'extraction. Le montage entier est en acier inoxydable pour éviter l'adsorption du composé organique. Par la suite, un dispositif à quatre capillaires est utilisé (C), pour éviter la rétro-diffusion du composé[21]. À ce point, la vapeur d'eau et le trichloroéthylène se retrouvent emprisonnés dans les trappes (T1 et T2) qui sont refroidies à l'azote liquide à . La première trappe (T1) est plongée à 50 % dans l'azote liquide, alors que la seconde trappe (T2) est plongée à 100 % dans l'azote liquide. La justification est que, quand les deux trappes sont entièrement submergées, l'efficacité de l'extraction est diminuée de 50 %, car les vapeurs d'eau gèlent et bloquent le flux de vapeur) [22]. Sur 500 ml de l'échantillon d'eau souterraine uniquement, 0, 4 ml est emprisonné dans la trappe (T1) et c'est dans ce volume qu'est renfermé le composé organique volatil le trichloroéthylène. Sachant que le composé se retrouve presque entièrement emprisonné dans la première trappe, la seconde trappe ne s'avère pas principale pour l'extraction. La trappe (T1) qui contient l'analyte préconcentré est conservée et branchée sur le dispositif d'analyse P&T-GC-MSIR. L'analyte est chauffé à 250 °C pour une minute et est désorbé thermiquement du P&T et envoyé par un flux d'hélium vers une cellule cryogénique à -120 °C. Par la suite, la cellule cryogénique est chauffée et l'hélium envoi l'analyte vers le GC pour faire la séparation chromatographique) [23]. La séparation se fait à une température de 40 °C pendant 2 minutes, 50 °C à un rythme de 2 °C/minute, 50 °C pour 4 minutes, 100 °C à un rythme de 8 °C/minute, 100 °C pour 2 minutes, 210 °C à un rythme de 40 °C/minute et finalement 210 °C pour 3, 5 minutes[24]. Une fois les composés organiques scindés, ils sont analysés par MSIR. Avec le spectromètre de masse avec ratio isotope, on peut déterminer la signature isotopique du trichloroéthylène. Il sert à déterminer l'abondance du 13C et du 12C avec le ratio 13C / 12C. En utilisant la technique de pompe à extraction, le pourcentage de recouvrement fluctue entre 80 et 110 % (4). La limite de quantification était de 1, 4 μg·l-1 pour le P&T et s'est abaissée à 0, 24 μg·l-1[25] en combinant avec la pompe à extraction.
Recherche
- 2007. Des chercheurs de l'Université de Washington ont développé un peuplier OGM capable de métaboliser et détruire le trichloréthylène souillant des sites industriels pollués. [réf. nécessaire]
Notes et références
- TRICHLORŒTHYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, John Wiley & Sons Ltd, England, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- Properties of Various Gases sur flexwareinc. com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Gulf Pub. Co., Huston, Texas, 1996 (ISBN 0-88415-857-8, ISBN 0-88415-858-6, ISBN 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd. , 2736 p. (ISBN 9781420066791) , p. 10-205
- ESIS. Consulté le 1 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, «Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2A : Certainement cancérogènes pour l'homme» sur http ://monographs. iarc. fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- «Trichloréthylène» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Trichlorœthylene sur hazmap. nlm. nih. gov. Consulté le 14 novembre 2009
- carcinogène : qui peut donner le cancer (synonymes : cancérigène, cancérogène)
- Centre Canadien d'hygiène et de sécurité au travail (1998). Trichloroéthylène. Effet du trichloroéthylène sur la santé. /chemicals/chem_profiles/trichlorœthylene/. Dernier accès 23 mars 2010
- Santé Canada (2009). Recommandation pour l'eau potable au Canada. Le trichloroéthylène. [1]
- Centre Canadien d'hygiène et de sécurité au travail (1998). Trichloroéthylène. Effet du trichloroéthylène sur la santé. /chemicals/chem_profiles/trichlorœthylene/. Dernier accès 23 mars 2010
- Santé Canada (2009). Recommandation pour l'eau potable au Canada. Le trichloroéthylène. [2]. Dernier accès 23 mars 2010
- [3] Radio-Canada - Reportage : Cancers à Shannon
- Agency for Toxic Substances and Disease Registry (ATSDR), Survey of Childhood Cancers and Birth Defects at USMC Camp Lejeune (Full Report) , juillet 2003.
- Amaral If Helena; Berg Michæl; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ. Sci. Technol, 2010, 44, 1023-1029
- Amaral If Helena; Berg Michæl; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ. Sci. Technol, 2010, 44, 1023-1029
- Amaral If Helena; Berg Michæl; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ. Sci. Technol, 2010, 44, 1023-1029
- Amaral If Helena; Berg Michæl; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ. Sci. Technol, 2010, 44, 1023-1029
- Amaral If Helena; Berg Michæl; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ. Sci. Technol, 2010, 44, 1023-1029
- Zwank L. ; Berg M. ; Schmidt T. ; Haderlain S. ;, «Compound-specific Carbon isotope Analysis of volatile organic compounds in the low-microgram per liter range», Anal. Chem. 2003, 75, 5575-5583
- Amaral If Helena; Berg Michæl; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ. Sci. Technol, 2010, 44, 1023-1029
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 04/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité