Acide chromique
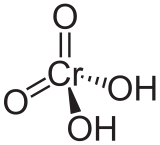
L'acide chromique est un diacide. C'est un oxacide de formule H 2 Cr O 4. Par la perte de deux protons, il forme l'ion chromate.

Catégories :
Composé du chrome - Produit chimique très toxique - Produit chimique comburant - Produit chimique dangereux pour l'environnement - Produit chimique corrosif - Cancérogène chimique - Produit chimique mutagène - Réactif pour la chimie organique - Oxoacide
Recherche sur Google Images :

Source image : hellopro.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Acide chromique, chromate de sodium, chromate de potassium, dichromate de sodium, dichromate de potassium, trioxyde de chrome (ou anhydride chromique).... (source : bossons-fute)
- Acide chromique se rapporte le plus souvent à une collection de composés produit par l'acidification de contenir de solutions chromate et dichromate anions ou... (source : worldlingo)
- L'acide chromique se comporte de même. Pour les chromates neutres alcalins, l'absorption qui paraît s'exercer de part et d'autre du spectre, ... (source : afst.cedram)
| Acide chromique | ||||
|---|---|---|---|---|
 |
||||
| Général | ||||
| Nom IUPAC | acide chromique chromate d'hydrogène |
|||
| No CAS | ||||
| No EINECS | ||||
| Propriétés chimiques | ||||
| Formule brute | H2CrO4 [Isomères] |
|||
| Masse molaire[1] | 118, 0096 ± 0, 0019 g·mol-1 H 1, 71 %, Cr 44, 06 %, O 54, 23 %, |
|||
| pKa | 0, 8 | |||
| Précautions | ||||
|
|
||||
|
||||
|
|
||||
| Phrases R : 9, 24/25, 26, 35, 42/43, 45, 46, 48/23, | ||||
| Phrases S : 43, 45, 60, 61, | ||||
|
|
||||
|
||||
|
|
||||
   |
||||
|
|
||||
L'acide chromique est un diacide. C'est un oxacide de formule H2CrO4. Par la perte de deux protons (H+), il forme l'ion chromate.
En industrie et santé, l'expression «acide chromique» est quelquefois aussi utilisée pour le trioxyde de chrome (CrO3) ou «anhydride chromique». En pharmacie, le terme sert à désigner une solution aqueuse à usage externe de chrome-trioxyde dénommée à tort «soluté officinal d'acide chromique», en application locale par tamponnement nasal, dilué au tiers, pour cautériser les épistaxis (saignements de nez).
L'acide chromique et ses sels nommés chromates sont des composés du chrome à l'état d'oxydation +6. Ils ont par conséquent des propriétés oxydantes particulièrement utilisées en chimie organique, par exemple pour l'oxydation de l'aniline en quinone. Le mélange Na2Cr2O7, dichromate de sodium, est un exemple de composé utilisé.
L'ion chromate de couleur jaune a tendance à se dimériser en solution aqueuse pour former l'ion dichromate de formule Cr2O72- de couleur orange. Dans certaines conditions, on obtient une polymérisation et la production de polychromates de formule CrnO3n+12- de couleur rouge.
Synthèse de l'acide
La synthèse se fait par oxydation de chrome-III en chrome-VI, qui peut, selon les conditions, donner un ion chromate, l'acide ou l'oxyde CrO3.
On peut remarquer qu'on trouve des chromates dans la nature comme le chromate de plomb PbCrO4.
Utilisation
L'acide lui même est peu utilisé mais on se sert des chromates comme oxydant puissant et facile à utiliser en chimie organique. L'ion chromate peut aussi servir à précipiter certains ions en solution aqueuse en chimie analytique.
Il est aussi utilisé en histologie comme fixateur[4].
Toxicité
L'ion chromate est connu être toxique contrairement aux dérivés du chrome III, et il faut prendre des précautions spécifiques pour utiliser les chromates.
Notes et références
- Masse molaire calculée selon Atomic weights of the elements 2007 sur www. chem. qmul. ac. uk
- Entrée du numéro CAS «7738-94-5» dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript indispensable)
- «Acide chromique» dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- http ://www. imedecin. com/Article386. htm
Voir aussi
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 04/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité