Acide
Un acide est un composé chimique le plus souvent défini par ses réactions avec un autre type de composé chimique complémentaire, les bases.
Définitions :
- Qualifie une saveur aigre ou piquante; Qualifie une molécule capable de céder un proton (acide de Bronsted) ou d'accepter un doublet électronique (acide de Lewis) ; Qualifie une solution dont le pH est inférieur à 7, c'est-à-dire lorsque la concentration en protons de la solution est supérieure à ... (source : fr.wiktionary)
- se dit d'un vin dont l'acidité particulièrement élevée lui donne un caractère mordant et vert. (source : saq)
Un acide est un composé chimique le plus souvent défini par ses réactions avec un autre type de composé chimique complémentaire, les bases.
Définitions
L'acidité fut en premier lieu définie par Svante August Arrhenius à la fin du XIXe siècle : un acide est un composé chimique pouvant libérer des protons (ions H+) en solution aqueuse et une base un composé chimique pouvant libérer des ions hydroxydes (HO-) en solution aqueuse. Mais cette définition n'était pas suffisament générale et n'expliquait pas la basicité de certains composés chimiques ne libérant pas de HO- en solution aqueuse.
Acide de Bronsted
Selon la théorie de Brønsted-Lowry, énoncée en 1923, un acide est toute espèce qui peut libérer un ou plusieurs protons, et une base toute espèce qui peut capter un ou plusieurs protons. Les protons ne pouvant exister à l'état libre en solution, la théorie de Brønsted met l'accent sur le couple acide-base :
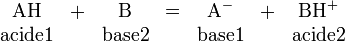
Les réactions qui ont lieu entre un acide et une base sont appelées «réactions acido-basique», ou «réactions acide-base». Un tel acide est nommé acide de Brønsted.
Dans cette théorie, l'autoprotolyse de l'eau s'interprète comme la réaction de l'acide eau sur la base eau. L'eau est par conséquent un ampholyte.
L'avantage de cette théorie sur la théorie d'Arrhenius est double :
- La théorie justifie que certaines espèces comme l'ammoniac soient basiques
- La théorie ne donne pas d'importance spécifique au solvant, on peut par conséquent parler de réaction acido-basique, même en phase gazeuse
Acide de Lewis
La définition de Lewis (1923) est de loin la plus large : un acide de Lewis est accepteur de doublets, ayant par conséquent une orbitale vide, et une base de Lewis est un donneur de doublets, ayant un doublet libre. Par cette définition, un acide est un composé chimique qui peut, au cours d'une réaction, accepter une paire d'électrons (un doublet). C'est par conséquent un composé chimique électrophile, qui possède une lacune électronique dans sa structure.
On peut facilement reconnaitre un acide grâce à des tests de pH. Une solution acide a un pH inférieur à 7, à 25 °C. Plus le pH est bas, plus l'acidité est forte. Pour mesurer le pH, on peut effectuer différents tests : papiers pH, indicateurs colorés, utilisation d'un pH-mètre, feuilles de choux rouge, etc.
Les espèces acides au sens de Bronsted peuvent libérer un ou plusieurs protons on parle alors respectivement de monoacides et de polyacides
Acide dans l'eau
Pour les réactions dans l'eau, on utilise généralement la définition de Brønsted. Un acide peut être représenté par la formule générique AH.
On établit une distinction entre les acides faibles et les acides forts. Ces derniers sont caractérisés par le fait que quand ils sont positionnés dans l'eau, l'entité AH n'existe plus en solution car la réaction de dissociation est totale.
Parmi les acides forts, on retrouve les hydracides (tels les acides halohydriques HCl, HBr, HI) et les oxacides (molécules acides possédant un atome central avec un haut degré d'oxydation entouré d'atomes d'oxygène, par exemple : acide nitrique, acide sulfurique, acide perchlorique, acide permanganique).
On classe les acides faibles (acide formique, acide acétique «vinaigre») selon leur constante d'acidité.
Dans l'eau, l'acidité est mesurée avec l'échelle des pH. L'eau est à la fois un acide faible et une base faible (c'est un amphotère ou ampholyte).
On ne parle plus d'acide/base «Fort (e) s», mais d'acide ou base «complètement dissociée».
On compare généralement la «force» des acides avec l'eau selon la réaction générale suivante :
AH + H2O ⇔ A- + H3O+
Plus la réaction est déplacée vers la droite plus l'acide est fort. Certaines classes d'acide comme l'acide chlorhydrique décalent la réaction totalement vers la droite. Il n'est alors plus envisageable de les comparer car ils donnent tous le même résultat.
Ce phénomène est dû au solvant et on parle d'effet nivelant de l'eau. Pour comparer les «forces» des acides/bases complètement dissociés, on utilisera un autre solvant (exemple : éthanol…) moins réactif, c'est-à-dire moins basique.
Dans l'eau, l'acide le plus fort est H3O+ (H+aqueux) et la base la plus forte est HO-. Il convient de garder en mémoire que ces notations (H3O+ et HO-) ne forment qu'une simplification schématique du dispositif. Dans la réalité, H+ et HO- sont tous deux entourés par une sphère de solvatation (plusieurs molécules d'eau, polaires, établissant des liaisons de type électrostatique avec les ions). Une notation plus rigoureuse devrait par conséquent être H (H2O) n+ et HO (H2O) n-. Cependant, cette notation plus rigoureuse n'apporte rien à la compréhension des phénomènes acido-basiques.
Acides dans d'autres solvants
La généralisation de la notion d'acidité a permis d'étendre l'étude à d'autres solvants.
Solvants protiques
Ce sont des solvants capables de céder et capter un ion H+, nommé couramment proton (d'où le terme «protique»). Par exemple NH3 (donne NH2- et NH4+), HF, CH3COOH, H2SO4, etc.
Dans ces solvants, la notion de couple acide-base reste centrée sur l'échange de protons et les couples dans ces solvants restent les mêmes que dans l'eau. L'intérêt de ce type de solution vient de la réaction d'autoprotolyse du solvant qui limite la force des acides (et des bases) pouvant exister en solution. On utilisera par conséquent un solvant plus basique que l'eau comme NH3 pour travailler avec des bases particulièrement fortes comme H-CC :- ; et un solvant plus acide comme H2SO4 pour travailler avec des acides forts.
Solvants non protiques
Le transfert particule peut se faire avec autre chose qu'un proton. Dans un solvant comme NO2, on a la réaction 2 NO2 → NO3- + NO+ qui peut être vue comme le transfert d'un ion O2- c'est la définition des acides de Lux-Flood. On peut alors définir une base comme un donneur d'ion O2- (riche en électron) et un acide comme un accepteur d'ion O2-. Dans d'autres cas c'est un transfert d'ion F-. Ce type de conception des réaction en solution joue un rôle important en métallurgie et dans l'étude des roches (voir ci-dessous).
Acides en géologie
En géologie, on dit qu'une pierre est acide si elle renferme plus de 65 % de silice. Ceci est une règle qui traduit la définition des acides de Lux-Flood : la silice qui est un accepteur d'ion oxyde O2- est acide.
- SiO2 + H2O = H2SiO3
Donc les roches riches en silice sont acides, les roches riches en calcaire sont basiques. Cela a une importance pour comprendre le comportement des magmas (surtout dans les volcans), et quand on veut dissoudre une roche pour l'analyser, par exemple dissolution dans un acide pour analyse par ICP ou bien dissolution dans un verre pour analyse par spectrométrie de fluorescence X (technique dite de la «perle fondue»).
Pour cette dernière application, on estime fréquemment l'acidité par l'indice d'acidité, qui est le nombre d'atomes d'oxygène divisé par le nombre d'autres atomes ; par exemple, le SiO2 a un indice d'acidité de 2, le CaCO3 a un indice d'acidité de 1, 5.
Goût
Le goût acide s'est vu consacré grâce à des récepteurs spécifiques PKD2L1, qui sont certainement sensibles à la présence des ions H+, ou à certains nucléotides cycliques. Malgré certaines études on sait désormais que sa reconnaissance est indépendante de la reconnaissance du goût salé. Ces récepteurs jouent aussi un rôle physiologique important dans le reste de l'organisme et sont exprimés à la surface de certaines cellules pour contrôler la quantité de CO2 dans le sang ou la quantité de liquide cérébrospinal.
Dissolution acide
Une des principales propriétés des solutions acides est de pouvoir dissoudre la plupart de matériaux. Le pouvoir de dissolution dépend de la concentration de l'acide et de la nature chimique du matériau et de l'acide.
Les métaux, lorsque le potentiel redox du couple cation / métal dérivant de ce métal est inférieur à 0, ne sont pas stables dans les solutions acides, ils sont par conséquent oxydés (c'est-à-dire ionisés par perte d'un ou plusieurs électrons) ; l'ion métallique peut alors rester sous forme dissoute (solvatée), ou se combiner avec un ou plusieurs ions oxygène et former un oxyde. L'acidité est un des paramètres importants de la corrosion aqueuse. La dissolution des métaux est utilisée en gravure d'art, c'est la technique de l'eau-forte ; elle est aussi utilisée en métallographie pour révéler des défauts (par exemple joints de grain).
Le calcaire se dissout facilement avec des acides faibles ; on nettoie les robinetteries avec du jus de citron (acide citrique) ou du vinaigre (acide acétique).
Les verres peuvent être dissous par de l'acide fluorhydrique, mais la manipulation de cet acide est extrêmement dangereuse, du fait de la présence d'ions fluorures.
Les acides concentrés peuvent provoquer des brûlures sur la peau et les muqueuses (yeux, nez, bouche). En cas de brûlure par acide, il faut :
- protéger : en se protégeant (gants…), fermer le récipient et éviter que l'acide ne se répande (utilisation de papier absorbant), ouvrir les fenêtres pour éviter les dégagements de vapeurs ;
- retirer les vêtements imbibés (en faisant attention à ne pas contaminer d'autres personnes ou des parties saines de la victime) ;
- faire ruisseler de l'eau pour laver la partie atteinte, en évitant de contaminer les parties saines ;
- prévenir les secours («112» dans l'Union européenne, «15» en France) en mentionnant le produit en cause.
L'utilisation d'acides concentrés doit toujours se faire par des personnes constituées et équipées (blouse, gants, lunette), sous hotte.
Exemples d'acides
Voici quelques-uns des principaux acides :
- l'acide acétique, de formule (CH3COOH), acide principal du vinaigre ;
- l'acide acétylsalicylique, de formule (HC9H7O4), plus connu sous le nom d'aspirine ;
- l'acide ascorbique, de formule (H2C6H6O6), plus connu sous le nom de vitamine C ;
- l'acide citrique, de formule (H3C6H5O7), un acide présent dans les agrumes ;
- l'acide chlorhydrique, de formule (HCl, en solution aqueuse : H3O++ Cl- (aq) ), fréquemment utilisé dans l'industrie.
Bibliographie
- F. Claisse, Physics and chemistry of borate fusion
Recherche sur Google Images : |
|
"L'acide fluorhydrique" L'image ci-contre est extraite du site apprendreagraff.free.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (500 × 336 - 31 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 04/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité