Intoxication au toluène
Le toluène, aussi nommé méthylbenzène ou phénylméthane est un hydrocarbure aromatique sous la forme d'un liquide transparent, particulièrement répandu et utilisé comme produit de départ industriel ou comme solvant.

Catégories :
Toxicologie - Maladie professionnelle - Hygiène et sécurité - Droit du travail - Pollution - Intoxication
Le toluène, aussi nommé méthylbenzène ou phénylméthane est un hydrocarbure aromatique sous la forme d'un liquide transparent, particulièrement répandu et utilisé comme produit de départ industriel ou comme solvant. Sa manipulation comporte des risques pour la santé de l'utilisateur. Les troubles génèrés chez les travailleurs sont d'ailleurs reconnus au titre de la maladie professionnelle.
| Toxicologie | |
|---|---|
 |
|
| Toluène | |
| Numéro CAS | 108-88-3 |
| Formule chimique | C7H8 |
| Masse moléculaire | 92.14052 |
| Biodisponibilité | |
| Métabolisme | |
| Excrétion | Poumons |
| Voies d'exposition | Peau, Poumons |
| hydrocarbure aromatique | |
Métabolisme chez l'homme
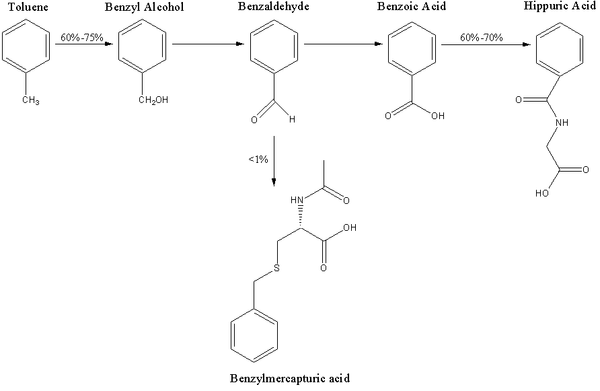
Même si une importante quantité du toluène, 25% à 40%, est expirée sous forme inchangée par les poumons, la plus grande partie est métabolisée et excrétée par d'autres voies d'élimination. La principale voie du métabolisme du toluène est celle de l'hydroxylation en alcool benzylique par la chaîne des enzymes de la famille du cytochrome p450 (CYP) [1]. Il existe cinq CYP qui ont un rôle important dans le métabolisme du toluène, CYP1A2, CYP2B6, CYP2E1, CYP2C8 et CYP1A1 [2]. Les quatre premiers semblent être impliqués dans l'hydroxylation du toluène en alcool benzylique. La CYP2El semble être la principale enzyme intervenant dans l'hydroxylation du toluène, représentant à peu près 44% du métabolisme du toluène[1] cependant, il existe une grande variabilité ethnique, dans la population finlandaise, par exemple la principale enzyme est la CYP2B6. La CYP2E1 catalyse la formation d'alcool benzylique et de p-crésol[1], [2] tandis que la CYP2B6 produit comparativement peu de p-cresol [2].
On estime que chez l'homme, l'alcool benzylique est métabolisé en benzaldéhyde par la CYP plutôt que par l'alcool déshydrogénase [3]. Cependant, cette conviction ne semble pas être universelle[4], [5]. La benzaldéhyde est métabolisée, à son tour, en acide benzoïque, essentiellement par l'aldéhyde déshydrogénase-2 mitochondriale (ALDH-2), tandis que seul un petit pourcentage est métabolisé par l'ALDH-1[5].
L'acide benzoïque est métabolisé soit en glucuronide de benzoyle ou en acide hippurique[4], [6]. Le glucuronide de benzoyle est produit par la réaction de l'acide benzoïque avec l'acide glucuronique (glycuroconjuguaison), qui représente 10-20 % de l'élimination de l'acide benzoïque. L'acide hippurique est aussi connu comme étant une benzoylglycine et est produit à partir de l'acide benzoïque en deux étapes : en premier lieu l'acide benzoïque est transformé en benzoyl-CoA par l'enzyme benzoyle-CoA synthétase, puis le benzoyl-CoA est transformé en acide hippurique par la benzoyl-CoA : glycine N -Acyltransférase[7]. L'acide hippurique est le principal métabolite urinaire du toluène[4].
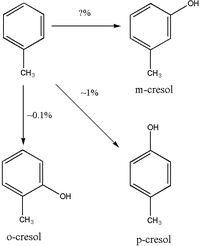
L'hydroxylation en crésols est une voie mineure dans le métabolisme du toluène. La majorité des crésols sont éliminés sous forme inchangée dans l'urine, mais une partie du p-crésol et du o-crésol est excrétée sous forme de conjugués. Les études chez le rat ont montré que le p-crésol est essentiellement conjugué avec l'acide glucuronique pour produire des p-cresylglucuronides, mais cela n'est peut être pas applicable à l'homme. [8] L'o-crésol semble être principalement excrété dans les urines sous forme inchangée ou que sous forme de glycuro ou sulfo conjugué. [9] Il semble y avoir des différents sur la question de savoir si le m-crésol est , ou non, un produit du métabolisme du toluène. [4][10]
Influences de l'environnement
Quand survient une exposition au toluène, il existe le plus souvent une exposition simultanée à plusieurs autres produits chimiques. [4] Fréquemment, l'exposition au toluène est concomitante avec une exposition au benzène et , comme les deux substances sont dans une certaine mesure, métabolisées par les mêmes enzymes, le rapport de leurs concentrations relatives permettra de déterminer leur taux d'élimination. [4] Bien sûr, plus le toluène est long à éliminer, plus il est susceptible d'avoir des effets nocifs.
La consommation en tabac et alcool des personnes exposées au toluène, détermine en partie l'élimination du toxique. Des études ont montré que même une consommation aigue modeste d'éthanol pouvait diminuer de manière significative la diffusion ou l'élimination du toluène dans le sang en accroissant l'exposition des tissus. [11] D'autres études ont montré que la consommation chronique d'éthanol pouvait accélérer le métabolisme du toluène par induction de la CYP2E1. [12] Il a été montré que le tabagisme pouvait augmenter le taux d'élimination du toluène, peut-être à cause d'une induction enzymatique. [13]
Le régime alimentaire peut aussi influer sur l'élimination du toluène. Une alimentation pauvre en hydrates de carbone et le jeûne ont l'ensemble des deux été présentés comme capables de provoquer l'induction de la CYP2E1 et , donc, d'augmenter le métabolisme du toluène. [12] Un régime alimentaire faible en protéines peut entrainer une diminution du contenu en CYP totale et ainsi diminuer le taux d'élimination du médicament. [12]
Mesure de l'exposition
L'acide hippurique a longtemps été utilisé comme indicateur d'exposition au toluène. [14]Cependant, il semble exister un doute sur sa validité. [15] Il existe une importante production endogène d'acide hippurique chez l'homme, avec des variations inter-et intra-individuelles influencées par des facteurs tels que l'alimentation, les traitements médicamenteux, la consommation d'alcool, etc. [15] Cela donne à penser que l'acide hippurique pourrait être un indicateur d'exposition au toluène peu fiable. [15][16] Il a été suggéré que l'acide hippurique urinaire, marqueur respectant les traditions d'exposition au toluène n'était tout simplement pas suffisament sensible pour différencier les personnes exposées des non-exposées. [17] Cela a conduit à étudier d'autres métabolites comme marqueurs d'exposition au toluène.
L'o-crésol urinaire pourrait être plus fiable pour la biosurveillance de l'exposition au toluène parce que, à la différence de l'acide hippurique, l'o-crésol n'est pas retrouvé à des niveaux détectables chez les sujets non exposés. [16] L'o-Crésol pourrait être un marqueur moins sensible de l'exposition au toluène que l'acide hippurique. [18]L'excrétion de l'o-Crésol pourrait être une méthode fiable pour mesurer l'exposition au toluène puisque l'o-crésol représente moins de 1% du total de l'élimination du toluène. [14]
L'acide benzylmercapturic, un métabolite mineur du toluène, est produit à partir de la benzaldéhyde. [19] Au cours des dernières années, des études ont suggéré d'utiliser l'acide benzylmercapturic urinaire comme marqueur preferentiel de l'exposition au toluène, parce qu'il n'est pas détecté dans les sujets non-exposés, qu'il est plus sensible que l'acide hippurique à de faibles concentrations, qu'il n'est pas affecté par l'alimentation ou la boisson, qu'il peut détecter une exposition au toluène à un niveau d'environ 15 ppm, et qu'il montre une meilleure relation dose effet avec l'exposition au toluène que l'acide hippurique ou l'o-crésol. [20][21]
Effets de l'exposition à long terme
De graves effets négatifs sur le comportement sont fréquemment associés à une exposition excessive au toluène liée à l'inhalation délibérée de solvants. [22] l'exposition au toluène à long terme est fréquemment associée à des manifestation telles que le syndrome psychoorganique [23]des anomalies des potentiels évoqués visuels (PEV), [23] des polyneuropathies toxiques, des atteintes cérébelleuses, cognitives et des pyramidales, [22][23]une atrophie optique et des lesions cérébrales. [22]
Le toluène provoque des tremblements posturaux par une augmentation des concentrations extracellulaires d'acide gamma-aminobutyrique (GABA) dans le cortex cérébelleux. [22] Le traitement par les agonistes du GABA tels que, les benzodiazépines procurent une certaine atténuation des tremblements induits par le toluène, mais aussi de l'ataxie. [22] Une alternative au traitement médicamenteux est la thalamotomie. [22] Les tremblements associés à l'abus de toluène ne semblent pas être un symptôme transitoire, mais on observe une évolution irréversible et progressive des symptômes qui continue après la cessation de l'intoxication aux solvants. [22]
Il existe certaines preuves qu'un faible niveau d'exposition au toluène peut provoquer des perturbations dans la différenciation des cellules précurseurs des astrocytes. [24] Cela ne semble pas être un risque majeur pour les adultes, mais l'exposition au toluène des femmes enceintes pendant les phases critiques du développement fœtal peut provoquer des troubles graves du développement neuronal. [24]
Références
- (en) Cet article est partiellement ou en totalité issu de l'article de Wikipédia en anglais intitulé «228450823 Toluene (toxicology) » (voir la liste des auteurs)
- (en) M Shou, T. Lu, KW Krausz, Y. Sai, T. Yang, KR Korzekwa, FJ Gonzalez et HV Gelboin, «Use of inhibitory monoclonal antibodies to assess the contribution of cytochromes P450 to human drug metabolism», dans European Journal of Pharmacology, vol. 394, no 2-3, 14 avril 2000, p. 199–209 [ lien PMID, lien DOI ].
- (en) T Nakajima, RS Wang, E. Elovaara, FJ Gonzalez, HV Gelboin, H. Raunio, O. Pelkonen, H. Vainio et T. Aoyama, «Toluene metabolism by cDNA-expressed human hepatic cytochrome P450», dans Biochemical Pharmacology, vol. 53, no 3, 07 février 1997, p. 271–7 [ lien PMID, lien DOI ].
- (en) DE Chapman, TJ Moore, SR Michener et G. Powis, «Metabolism and covalent binding of [14C]toluene by human and rat liver microsomal fractions and liver slices», dans Drug Metabolism and Disposition, vol. 18, no 6, November-December 1990, p. 929–36 [ lien PMID ].
- (en) Agency for Toxic Substances and Disease Registry, Toxicological profile for toluene, Agency for Toxic Substances and Disease Registry, Atlanta, GA, septembre 2000 (OCLC 47129207) [lire en ligne].
- (en) T. Kawamoto, K. Matsuno, Y. Kodama, K. Murata et S. Matsuda, «ALDH2 polymorphism and biological monitoring of toluene», dans Archives of Environmental Health, vol. 49, no 5, September-October 1994, p. 332–6 [ lien PMID ].
- (en) Organisation mondiale de la santé, Environmental Health Criteria No. 52 (Toluene) , World Health Organization, Geneva, 1985 (ISBN 92-4-154192-X) [lire en ligne].
- (en) Z. Gregus, T. Fekete, E. Halászi et C. D. Klaassen, «Lipoic acid impairs glycine conjugation of benzoic acid and renal excretion of benzoylglycine», dans Drug Metabolism and Disposition, vol. 24, no 6, juin 1996, p. 682–8 [ lien PMID ].
- (en) G Lesaffer, R De Smet, T D'Heuvært, FM Belpaire, N Lameire et R Vanholder, «Comparative kinetics of the uremic toxin p-cresol versus creatinine in rats with and without renal failure», dans Kidney International , vol. 64, no 4, October 2003, p. 1365–73 [ lien PMID, lien DOI ]
- L Wilkins-Haug, «Teratogen update : toluene», dans Teratology, vol. 55, no 2, February 1997, p. 145–51 [ lien PMID, lien DOI ]
- (en) W Tassaneeyakul, DJ Birkett, Edwards, ME Veronese, W Tassaneeyakul, RH Tukey et JO Miners, «Human cytochrome P450 isoform specificity in the regioselective metabolism of toluene and o-, m- and p-xylene», dans Journal of Pharmacology and Experimental Therapeutics , vol. 276, no 1, January 1996, p. 101–8 [ lien PMID ]
- (en) M Wallen, PH Näslund et MB Nordqvist, «The effects of ethanol on the kinetics of toluene in man», dans Toxicology and Applied Pharmacology , vol. 76, no 3, December 1984, p. 414–9 [ lien PMID ]
- (en) T Nakajima, RS Wang et N Murayama, «Immunochemical assessment of the influence of nutritional, physiological and environmental factors on the metabolism of toluene», dans International Archives of Occupational and Environmental Health , vol. 65, no 1 Supplement, 1993, p. S127–30 [ lien PMID, lien DOI ]
- (en) EW Hjelm, PH Näslund et M Wallén, «Influence of cigarette smoking on the toxicokinetics of toluene in humans», dans Journal of Toxicology and Environmental Health , vol. 25, no 2, 1988, p. 155–63 [ lien PMID ]
- (en) Y Duydu, S Süzen, N Erdem, H Uysal et N Vural, «Validation of hippuric acid as a biomarker of toluene exposure», dans Bulletin of Environmental Contamination and Toxicology , vol. 63, no 1, July 1999, p. 1–8 [ lien PMID, lien DOI ]
- J Angerer, «Occupational chronic exposure to organic solvents. XII. O-cresol excretion after toluene exposure», dans International Archive of Occupational and Environmental Health , vol. 56, no 4, 1985, p. 323–8 [ lien PMID, lien DOI ]
- J Angerer, «Occupational chronic exposure to organic solvents. XVI. Ambient and biological monitoring of workers exposed to toluene», dans International Archives of Occupational and Environmental Health, vol. 69, no 2, 1997, p. 91–6 [ lien PMID, lien DOI ]
- O Inoue, «Effects of smoking and drinking on excretion of hippuric acid among toluene-exposed workers», dans International Archives of Occupational and Environmental Health, vol. 64, no 6, 1993, p. 425–30 [ lien PMID, lien DOI ]
- O Inoue, «Effects of smoking and drinking habits on urinary o-cresol excretion after occupational exposure to toluene vapor among Chinese workers», dans American Journal of Industrial Medicine , vol. 25, no 5, May 1994, p. 697–708 [ lien PMID ]
- S Laham, «Biological conversion of benzaldehyde to benzylmercapturic acid in the Sprague-Dawley rat», dans Drug and Chemical Toxicology , vol. 10, no 3-4, 1987, p. 209–25 [ lien PMID ]
- O Inoue, «Benzylmercapturic acid is superior to hippuric acid and o-cresol as a urinary marker of occupational exposure to toluene», dans Toxicology Letters , vol. 147, no 2, 2004-03-01, p. 177–86 [ lien PMID, lien DOI ]
- O Inoue, «Urinary benzylmercapturic acid as a marker of occupational exposure to toluene», dans International Archives of Occupational and Environmental Health, vol. 75, no 5, June 2002, p. 341–7 [ lien PMID, lien DOI ]
- Y Miyagi, «», dans Journal of Neurology Neurosurgery and Psychiatry , vol. 66, no 6, June 1999, p. 794–6 [ lien PMID ]
- P Urban, «Neurological and neurophysiological follow-up on workers with severe chronic exposure to toluene», dans Neurotoxicity, vol. P25, no s130, 2003
- H Yamaguchi, «Toluene at environmentally relevant low levels disrupts differentiation of astrocyte precursor cells», dans Archives of Environmental Health, vol. 57, no 3, May-June 2002, p. 232–8 [ lien PMID ]
Liens externes
- ATSDR - Case Studies in Environmental Medicine : Toluene Toxicity U. S. Department of Health and Human Services (public domain)
Recherche sur Google Images : |
|
"Intoxication au toluène -" L'image ci-contre est extraite du site fr.wikipedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (600 × 391 - 37 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 04/11/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité